RNA干扰(RNAI)是一种内源性的基因调控机制,它能够调控大约30%的基因表达。这一过程是由小干扰RNA(SIRNA)所触发的,SIRNA能够精确地识别并抑制与其序列互补的基因MRNA,展现出极高的特异性,以用于治疗包括癌症在内的多种疾病。然而SIRNA易被核酸酶降解,难以进入细胞内部。因此,在细胞内将SIRNA完整地递送到目标位置仍然具有挑战性。
目前,球形核酸(SNA)由围绕纳米粒子核心密集排列的寡核苷酸组成,已显示出作为SIRNA纳米载体的良好前景。它们的临床应用已在伤口愈合受损和牛皮癣的动物模型中得到证实,并在治疗胶质母细胞瘤的首次人体临床试验中得到证实。然而,SIRNA的细胞输送效率限制了SIRNA-SNA的潜在治疗应用。具体来说,由于SIRNA的双链效率较低(低于50%),其在靶点的积累受到了限制。此外,SNA通过受体介导的内吞作用进入细胞后,经常会被困在内溶酶体,而不是释放到细胞质中。
为了提高寡核苷酸的可及性并实现高效的载荷捕获,华东师范大学田阳、刘蒙蒙及上海交通大学樊春海开发了一种基于四面体DNA框架(TDF)的界面工程方法,构建基于DNA框架的球形核酸(TDF-SNA)。具体来讲,受冠状病毒动态、多刺的结构启发,他们通过界面工程将载带SIRNA的TDF通过AU-S键修饰在金纳米颗粒上,使其在核心纳米颗粒表面均匀排列,形成类似冠状病毒表面的具有灵活构象的尖刺结构。
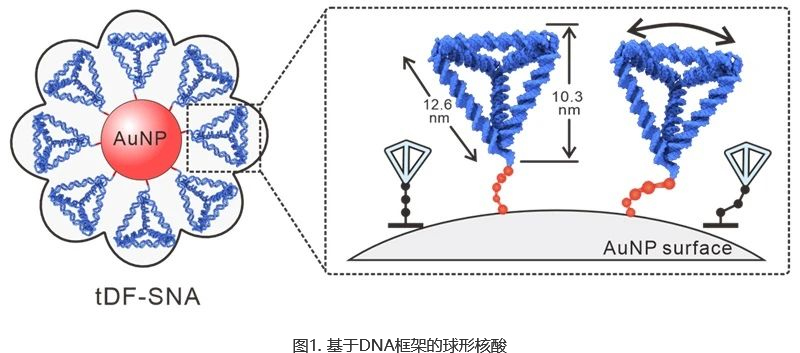
研究团队观察到,当单链DNA在球形核酸上折叠成坚固的TDF时,杂交效率显著提高。同时,TDF在金纳米颗粒表面表现出灵活的倾斜和旋转,这有利于几何匹配介导的多价相互作用,能够极大提高SIRNA的杂交效率,连接效率达到95%。更重要的是,尖刺结构的存在改变了其在细胞内的命运,提高了其吸收效率,从而增强了TDF-SNA的内溶酶体逃逸和胞质定位。这些特征的变化大大提高了SIRNA的递送效率(1-2个数量级),使其特异性基因沉默效率提高了2倍。总之,通过TDF的界面修饰方法,极大提高了SNA的杂交率与内吞效率,并最终实现了SIRNA在细胞内的高效传递。这一成果展示了动态尖刺结构在提高球形核酸传递效率中的关键作用,为制造生物启发型纳米载体提供了新的方法,也为生物控制、治疗和诊断等领域的应用开辟了新的道路。
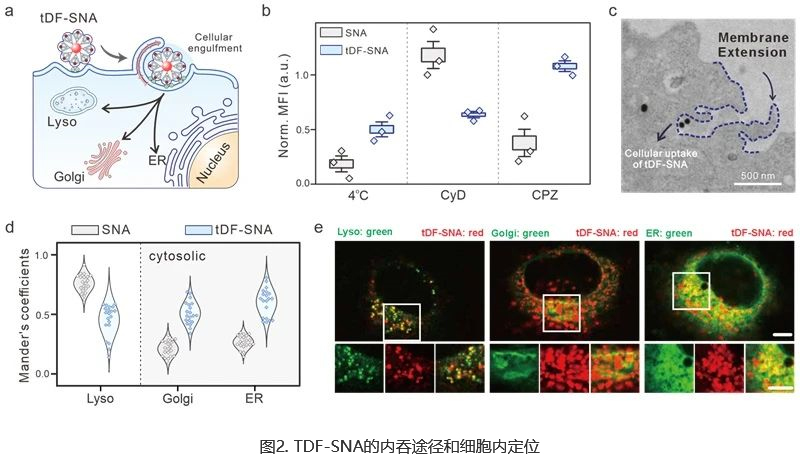
(A) TDF-SNAS内吞示意图。(B) 不同内吞抑制剂和条件下NPS的细胞摄取效率:4℃、网格蛋白介导内吞作用抑制剂(CPZ,氯丙嗪)、吞噬/巨胞饮抑制剂(CYD,细胞松弛素D)。(C) TDF-SNAS内吞的TEM图像。与HELA细胞培养24小时后,TDF-SNAS(红色)与溶酶体、高尔基体和内质网(绿色)等不同细胞器(绿色)的胞内共定位效率(D)和代表性共聚焦图像(E)。
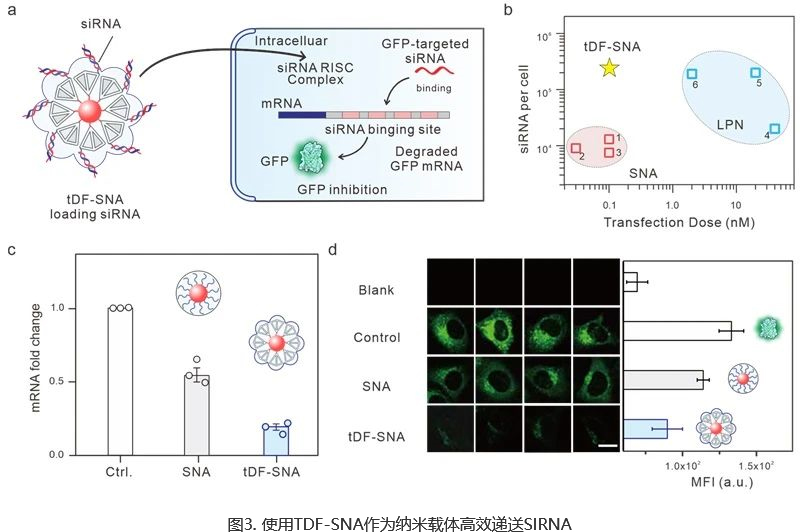
(A) TDF-SNA作为纳米载体递送SIRNA示意图。(B) 常用纳米载体的转染剂量和SIRNA转染数量汇总。(C) 用载带SIRNA的纳米颗粒处理细胞24小时后,GFP-MRNA表达水平的RT-QPCR分析。(D) 载带SIRNA的纳米颗粒与表达GFP的细胞孵育24小时后的共聚焦和流式细胞术分析。

